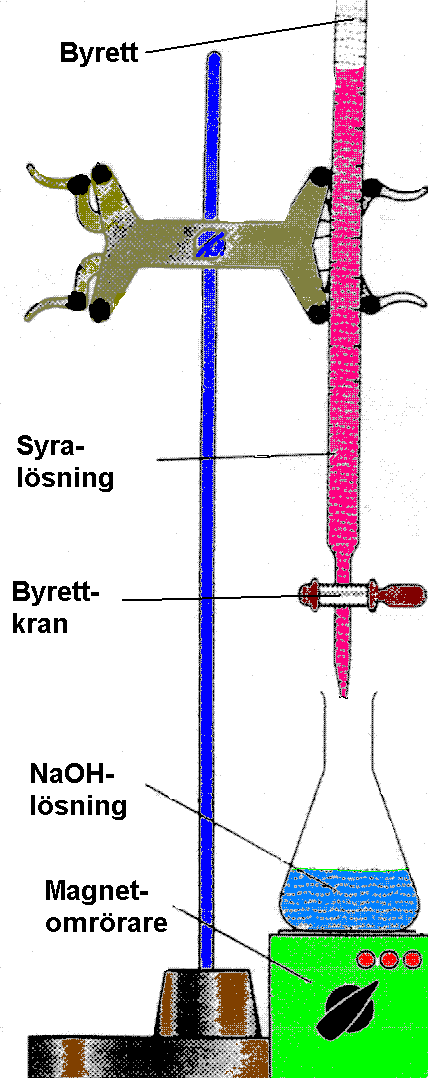
 Vi sköljer ur byretten med syra (på grund av att natriumhydroxiden
föstör gummit i byretten har vi syran i byretten och hydroxiden
i E-kolven) och monterar den i stativet.
Vi sköljer ur byretten med syra (på grund av att natriumhydroxiden
föstör gummit i byretten har vi syran i byretten och hydroxiden
i E-kolven) och monterar den i stativet.ULF BRANDIN .......................................................LABRATIONS REDOGÖRELSE
Oxievångsvägen 360 ...................................................................Datum
238 39 OXIE .............................................................1996-12-16
Syra-bastitrering
Vi ska bestämma två syralösningars koncentration genom att titrera den med en natriumhydroxidlösning med känd koncentration
Material: E-kolv, slaskbägare, mätcylinder, pipet, pipetfyllare, byrett, byrett-tratt, byretthållare, stativ, magnetomrörare med liten stavmagnet, sprutflaska med avjonat vatten
Kemikalier: Natriumhydroxidlösning med känd koncentration, syralösning vars koncentration ska bestämmas, syra- basindikator (BTB)
Utförande:
 Vi sköljer ur byretten med syra (på grund av att natriumhydroxiden
föstör gummit i byretten har vi syran i byretten och hydroxiden
i E-kolven) och monterar den i stativet.
Vi sköljer ur byretten med syra (på grund av att natriumhydroxiden
föstör gummit i byretten har vi syran i byretten och hydroxiden
i E-kolven) och monterar den i stativet.
Vi häller i syran med hjälp av byrett-tratten och knackar lite lätt på röret för att få ut luftbubblorna.
Vätskenivån justeras genom att byrettkranen öppnas och syran sjunker till önskad nivå (läser av noggrant och antecknar)
Därefter mäter vi upp 20,0 ml NaOH med pipett och pipettfyllare och för över det till E-kolven som placeras mellan byretten och magnetröraren .
Stavmagneten ilägges och BTB tillsätts i E-kolven. Magnetröraren startas och byrett kranen öppnas försiktigt.
Vi håller handen på kranen så att vi omedelbart kan avbryta när lösningen skiftar till grönt.
Vi antecknar den tillsatta volymen syra och beräknar koncentrationen.
Resultat:.....Saltsyra V = 0,0224 dm3
...........................................n = ?
..........................................c = ?
Svavelsyra .............V = 0,0093 dm3
..............................n = ?
.............................c = ?
Natriumhydroxid V = 0,0200 dm3
...........................n = c × V = 0,1 × 0,02 = 0,002 mol
...........................c = 0,1 mol / dm3
Reaktionsformel: Saltsyra ..........NaOH (aq) + HCl (aq) ¾ ® NaCl (aq) + H2O
..................................................Na + OH- + H3O+ + Cl ¾ ® Na+ + 2H2O +Cl-
.............................................................. -(H+)-¯
Beräkningar: .....Förhållande 1:1
V 0,0200 dm3 0,0224 dm3
n = c × V 0,002 mol 1:1 nNaOH = 0,002 mol
c = n / V 0,1 mol / dm3 0,002 / 0,0224 = 0,0893 mol / dm3
Beräkningar:
Reaktionsformel: Svavelsyra 2NaOH (aq) + H2SO4 (aq) ¾ ® Na2SO4 (aq) + 2H1:2
Förhållande 1:1............................. -(H2+)-¯
V 0,0200 dm3 0,0093 dm3
n = c × V 0,002 mol 1:2 nNaOH = 0,001 mol
c = n / V 0,1 mol / dm3 0,001 / 0,0093 = 0,108 mol / dm3
Felkällor: Genom att jag gjort denna laboration efter de andra och tyvärr ej har deras resultat att jämföra med har jag svårt att veta hur mina värde är.
Felkällorna ligger i hur noga man mäter upp vätskorna och får stopp på tillsättningen vid neutralt läge (ekvivalenspunkten).